Herpes simples.
Brunella Cesconetto Grillo
Graduada pela Universidade Brasileira de Vitória, UNIVIX, Residência médica pelo Hospital Universitário Cassiano Antonio Moraes (HUCAM) da UFES, pós graduação em medicina infanto puberal pela UNIRIO e preceptora do ambulatório de infanto puberal do centro de especialidades Unimed Vitória, ES
Neide Aparecida Tosato Boldrini
Professora adjunta de Ginecologia e obstetrícia da UFES, médica do ambulatório de Patologias do Trato genital inferior e colposcopia do HUCAM-UFES, Doutorado em doenças infecciosas pela UFES e presidente da ABPTGIC-ES.
A infecção pelo Vírus Herpes Simples (HSV) é a principal causa de úlcera genital em todo o mundo, sendo o HSV-2 o sorotipo mais frequentemente implicado na sua etiologia. É doença infectocontagiosa, crônica e generalizada, sujeita a recidivas, tendo como agente etiológico duas cepas diferentes do vírus herpes simples, o tipo 1 (HSV-1) e o tipo 2 (HSV-2). Seu período de incubação varia de 1 a 26 dias após o contágio, sendo a média de 7 dias. A infecção e a reativação podem ser assintomáticas, e a transmissão ocorre predominantemente pelo contato sexual, podendo também ser transmitido da mãe para o filho durante o parto. O contato com lesões ulceradas ou vesiculadas é a via mais comum.
Herpes e HIV
O herpes genital está associado a um risco duas a três vezes maior de aquisição do HIV, podendo ser responsável por 40 a 60% das novas infecções pelo HIV em uma população com alta prevalência pelo HSV. O sinergismo entre a infecção pelo HSV-2 e a infecção pelo vírus da imunodeficiência adquirida (HIV) resulta em um aumento da frequência das reativações do HSV-2 em indivíduos HIV-positivos. Por outro lado, a infecção pelo HSV-2 aumenta o risco de aquisição do HIV e acelera a própria progressão da doença. Além disso, os indivíduos soropositivos para HSV-2 são mais propensos à forma sintomática da doença, incluindo surtos mucocutâneos mais freqüentes e mais graves.
Nos indivíduos coinfectados pelo HIV, os aspectos clínicos são assiduamente atípicos, podendo-se observar úlceras extensas, atípicas, graves e as quais tendem para a cronicidade com sobreinfecção bacteriana. Mais raramente, tem sido descritas formas hipertróficas pseudotumorais as quais simulam carcinoma espinocelular ou outras infecções virais (Figura 1).
A coinfecção HSV/HIV ocorre em 50 a 95% dos indivíduos, segundo estudos realizados em diferentes partes do mundo. Os vírus herpes simples constituem uma grande causa de morbidade em indivíduos imunodeprimidos.
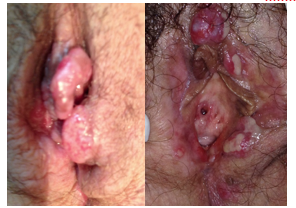
Figura 1. Lesão herpética hipertrófica em paciente HIV positiva. À esquerda observa-se aspecto tumoral inicial, após 10 dias da biópsia a lesão persistiu com aspecto ulcerado (à direita), no exame histopatológico frequentes células escamosas exibindo efeito citopático pelo vírus herpes.
Epidemiologia
O herpes genital é infecção comum e ascendente, tanto em países industrializados como naqueles em desenvolvimento. A grande maioria dos casos é causada pelo HSV-2, embora a prevalência do HSV-1 encontre-se em ascensão, principalmente na população jovem, devido à prática de sexo oral.
A infecção por HSV-2 é um problema mundial, e se calcula que haja no mundo 400 milhões de pessoas infectadas. Em 2012, a prevalência estimada da infecção era mais elevada na África (31,5%), seguida das Américas (14,4%). Há mais mulheres que homens infectados por HSV-2: 267 e 150 milhões, respectivamente, segundo estimativas de 2012. Nos grupos etários em que há início precoce de atividade sexual, as taxas de prevalência para HSV-2 chegam a 30% em adultos.
O HSV, A LATÊNCIA E REATIVAÇÃO.
Os HSV apresentam fenômeno biológico único, a capacidade de latência e de posterior reativação. Após uma primoinfecção, o vírus permanece em determinadas células sem provocar qualquer sintomatologia no hospedeiro, podendo ser reativado e, de novo, produzir viriões. Esta reativação pode ser sintomática ou não e é uma nova oportunidade de disseminação do HSV; a infecção torna-se crônica e tende a aumentar a prevalência. Os locais de latência variam: os vírus dermoneurotrópicos (HSV e VZV), após a primoinfecção, deslocam-se através da bainha periaxonial dos nervos sensitivos até atingirem os gânglios nervosos sensitivos correspondentes à região atingida. As células com HSV latente não se dividem, por isso não há produção de proteínas virais, o genoma do vírus comporta-se como se estivesse “desligado”.
Pacientes com deficiência de IgA apresentam ulcerações recorrentes da mucosa oral e, com frequência, infecções herpéticas. Fatores externos, como a exposição solar, a exposição a ambientes quentes ou frios; fatores internos, como a fadiga, o stress psicológico, o período menstrual, a relação sexual, a imunodepressão, a administração de corticosteróide, a febre, a cirurgia por laser, traumas teciduais localizados ou alteração na atividade antiviral da saliva desencadeiam a reativação. Também são mencionadas reações alérgicas, administração de adrenalina ou de hormônios hipofisários e emoções.
SINTOMATOLOGIA.
Quando sintomática, a primoinfecção é precedida por um pródromo, focalizado na zona da futura lesão, com dor, ardência e sensação de “formigamento”; estes sintomas duram cerca de 24 horas. A primoinfecção estabelecida manifesta-se inicialmente por cefaléia, febre, mal-estar e adenopatia inguinal, sintomas que costumam desaparecer antes da cura das lesões. Estas surgem 4 a 7 dias depois do início da infecção, sob a forma de vesículas dolorosas, de dimensão variável: na mulher, nos pequenos lábios, na vulva, na vagina e no trato urinário, podendo também atingir o colo do útero; no homem, no pênis, podendo também atingir o escroto. Na primoinfecção as lesões podem ser muito dolorosas e ocorrer também disúria e dificuldade de andar, mais comuns em mulheres, afetando psicologicamente a paciente. As vesículas rompem depois, ulceram e formam-se crostas sobre as lesões que curam, em geral sem deixar cicatrizes, em 2 a 6 semanas.
A persistência de lesões por várias semanas, ou o surgimento de novas lesões, pode levar o clínico a suspeitar de imunodepressão e a requerer os ensaios respectivos. Retenção urinária ocorre em 10-15% das pacientes do sexo feminino.
A gravidade da infecção primária parece estar relacionada com a frequência de recorrências, isto é, quanto mais grave a infecção primária, mais prováveis e frequentes serão as recorrências. Os portadores de HIV podem apresentar episódios de infecção mais prolongados e mais graves.
A complicação local mais comum é a infecção bacteriana secundária, mas podem surgir complicações sistêmicas, como a meningite asséptica, radiculomielite sacral e neuralgia. Esta é rara em homens, mas, em mulheres pode atingir 25% a 30% dos casos de primoinfecção.
DIAGNÓSTICO
1.Diagnóstico Clínico
O diagnóstico do herpes genital é essencialmente clínico, baseado na história médica e exame físico. Entretanto, em alguns casos, o diagnóstico clínico pode ser pouco sensível e inespecífico. As lesões típicas causadas pelo HSV (múltiplas, dolorosas, vesiculares ou ulcerativas) podem estar ausentes em muitas das pessoas infectadas.
A infecção primária e recorrente pelo HSV se faz habitualmente acompanhar de linfoadenopatia inguinal dolorosa e móvel.
2.Detecção direta do HSV.
Deve-se coletar o material das lesões com um swab de algodão ou dacron. Uma alternativa é a aspiração das vesículas intactas com agulha fina, pois os vírions são abundantes neste fluido. As amostras devem ser colocadas imediatamente em um meio de conservação/transporte adequado.
3.Citopatologia (Método de Tzanck).
Trata-se de um raspado do assoalho de uma vesícula íntegra com uma lâmina e cora-se pelo método de Giemsa, Wright ou Hematoxilina-eosina ou pelo Papanicolau; permite a observação de inclusões virais, que podem ser observadas em 50% dos casos. A positividade é dada pela presença de multinucleação e balonização celulares.
4.Testes virológicos.
O isolamento do HSV em cultura de células em pacientes que apresentam lesões genitais ulceradas ou outras lesões mucocutâneas
5.Testes para detecção de antígenos para o HSV.
Utilizado especialmente em pacientes que apresentam imunodeficiência. Pode ser detectada tanto por imunofluorescência com fluoresceína conjugada a anticorpo anti-HSV, como por ensaio imunoadsorvente ligado à enzima (ELISA). É possível realizar-se a tipagem viral através de anticorpo monoclonal.
Os testes de Polymerase Chain Reaction (PCR) do DNA do HSV são altamente sensíveis. A técnica de PCR está disponível e constitui o teste de eleição para o diagnóstico de infecção pelo HSV no sistema nervoso central (pesquisa de HSV em líquido cefalorraquiano) onde a titulação viral é baixa.
6.Hibridização do DNA-HSV.
A hibridização do DNA-HSV é utilizada, em particular, nos pacientes imunocomprometidos.
7.Testes sorológicos tipo-específicos para o HSV.
Anticorpos tipo-específicos e não específicos para o HSV se desenvolvem durante as primeiras semanas que se seguem à infecção pelo HSV e persistem indefinidamente. Estes testes se baseiam na presença de anticorpos contra as glicoproteínas G1 e G2 do HSV, que têm especificidades antigênicas para o HSV-1 e HSV-2, respectivamente.
O Western Immunoblot (WBA), que detecta anticorpos contra proteínas virais, e o Ensaio Imunoenzimático (EIA), que detecta anticorpos tipo-específicos contra a glicoproteína G, são testes sorológicos tipo-específicos, extremamente sensíveis e específicos. Entretanto, não há indicação de triagem para o HSV-1 e HSV-2 na população geral.
TRATAMENTO
A abordagem geral do tratamento, para cada caso, inclui a prevenção da transmissão, a atenuação da sintomatologia, a redução da possibilidade de complicações posteriores, a promoção da cura do episódio e a supressão possível dos episódios de recrudescência. Se os sintomas forem mínimos, poderá ser suficiente a utilização de analgésicos e de limpeza das lesões.
Para o primeiro episódio clínico, que tende a ser mais prolongado, com úlceras mais severas, podendo até conter acometimento neurológico, é recomendado tais esquemas; Aciclovir 400mg 3 vezes ao dia por 7-10 dias; Aciclovir 200 mg 5 vezes ao dia por 7-10 dias ou Valaciclovir 500 mg 2 vezes ao dia por 7-10 dias ou ainda Fanciclovir 250 mg 3 vezes ao dia por 7-10 dias.
A terapia supressiva tem como função reduzir a frequência das recidivas e melhorar ou amenizar a gravidade das lesões. Esta diminui a recorrência do herpes genital em 70-80%. A segurança e a eficácia foram documentadas entre pacientes que usam dose diária de Aciclovir por até 6 anos e Valaciclovir e Fanciclovir por 1 ano. Tais esquemas podem ser utilizados: Aciclovir 400 mg/dia; Valaciclovir 500mg- 1g/dia; Fanciclovir 250 mg/dia.
O uso diário de 500mg de Valaciclovir diminui a taxa de transmissão do HSV-2 em casais heterossexuais, funcionando também como uma estratégia para prevenir transmissão, além do uso do preservativo e evitar a atividade sexual durante as recorrências. A terapia supressiva também reduz a transmissão de pessoas com múltiplos parceiros, incluindo pessoas soropositivas para HSV-2 sem herpes genital. O tratamento do herpes genital recorrente, para ser efetivo, necessita ser iniciado no primeiro dia da lesão ou nos pródromos.
A transmissão neonatal é elevada (30-50%) para as gestantes que adquirem herpes próximo ao parto e menor de 1% para as que adquirem no primeiro trimestre. Mulheres sem o diagnóstico de herpes genital devem evitar ter relações sexuais, principalmente no terceiro trimestre, com parceiros sabidamente infectados. Testes sorológicos podem ser úteis na identificação dessas gestantes com risco de infecção. Embora o parto cesariano não elimine completamente o risco de transmissão neonatal, este deve ser recomendado caso a gestante apresente lesão herpética no início do trabalho de parto.
O Aciclovir pode ser usado para o tratamento do herpes genital em qualquer fase da gravidez, até naquelas que estão amamentando. Embora os dados sobre o uso gestacional do Valaciclovir e do Fanciclovir sejam limitados, estudos em animais demonstraram baixo risco em mulheres grávidas. O tratamento supressivo com Aciclovir reduz a taxa de cesareana, por diminuir a recorrência das lesões; porém, não reduz a transmissão neonatal.
O regime supressivo recomendado sugere que o tratamento seja iniciado a partir de 36 semanas de gestação com Aciclovir 400 mg 3x ao dia ou Valaciclovir 500mg/dia.
O tratamento intravenoso é reservado para as doenças severas ou suas complicações (pneumonite, encefalite e doenças disseminadas). A terapia anti-retroviral reduz a gravidade e a freqüência dos sintomas do herpes genital. As manifestações clínicas do herpes genital podem piorar durante a reconstituição imune logo após o início da terapia anti-retroviral.
Frequentemente, o herpes genital hipertrófico é refratário aos antivirais sistêmicos de primeira linha, tais como o Aciclovir (oral e endovenoso), o Valaciclovir e o Fanciclovir. Todas as estirpes resistentes ao Aciclovir, são também resistentes ao Valaciclovir e ao Fanciclovir. Nestes casos, o Foscarnet 40-80 mg/kg intravenoso, até a resolução clínica, deve ser aventado; assim como o Interferon-beta e Cidofovir 5 mg/kg uma vez por semana.
Ainda que não existam estudos randomizados, parece eficaz o uso do Imiquimod (imunomodulador tópico, com atividade antitumoral e antiviral que induz a síntese e libertação de várias citocinas endógenas pró-inflamatórias TH-1, nomeadamente de Interferon-alfa).
O Imiquimod deve ser aplicado nas lesões uma vez ao dia por 5 dias consecutivos. Outras drogas encontram-se ainda sob avaliação da sua eficácia, como a Trifluorotimidina, a Vidarabina e o Cidofovir, podendo ser utilizadas em casos especiais.
Autora:
Brunella Cesconetto Grillo
REFERÊNCIAS BIBLIOGRÁFICAS.
1 - Gubinelli E, Cocuroccia B, Lazzarotto T, Girolomoni G. Nodular perianal herpes simplex with prominent plasma cell infiltration. Sex TransmDis. 2003;30:157-9.
2 - Wald A, Link K. Risk of human immunodeficiency virus infection in herpes simplex virus type 2-seropositive persons: a meta-analysis. J InfectDis 2002; 185:45-52.
3 - Looker K, Garnett G. An estimate of the global prevalence and incidence of herpes simplex virus type 2 infection.Public health reviews. Bulletin of the World Health Organization 2008; 86:805-12.
4 - McCormack S, Walsh JC, Barton SE, Kiffer CRV. Herpes Simples. In: Focaccia R, editor. 3a ed. Tratado de Infectologia. São Paulo: Atheneu, p. 549-67, 2005.
5 - Samaratunga H, Weedon D, Musgrave N, McCallum N. Atypical presentation ofherpes simplex (chronic hypertrophic herpes) in a patient with HIV infection.Pathology. 2001;33:532-5.
6 - Foley E, Patel R. Treatment of genital herpes infections in HIV-infected patients. J HIV Ther 2004; 9:14-8.
7 - Looker K, Garnett G. An estimate of the global prevalence and incidence of herpes simplex virus type 2 infection. Public health reviews. Bulletin of the World Health Organization 2008; 86:805-12.
8 - Glasier A, Gulmezoglu AM, Schmid GP, Moreno CG, Van Look PF. Sexual and reproductive health: a matter of life and death. Lancet 2006; 368:1595-607.
9 - CDCP. (2014). Sexually Transmitted Diseases; Treatment Guidelines, 2010.Centers for Disease Control and Prevention. Atlanta, EUA. [Emlinha].Disponivelemhttp://www.cdc.gov/std/treatment/2014/genitalulcers.htm
10 - Strauss, E. e Strauss, J.(2002). Viruses and Human Disease. Academic Press, California.
11 - Howley, P. e Knipe, D. (2007). Fields Virology, Vol I. 5 th Edition. LippincottWilliam&Wilkins, Philadelphia.
12 - Sen P, Barton SE. Genital herpes and its management. BMJ 2007; 334:1048-52.
13 - Rana RK, Pimenta JM, Rosenberg DM et al. Sexual behaviour and condom use among individuals with a history of symptomatic genital herpes. Sex Transm Infect 2006; 82:69.
14 - Workowski KA, Berman MS. Sexually Transmitted Diseases Treatment Guidelines, 2006. MMWR Recomm Rep 2006 (RR-11); 55:1-95.
15 - Corey L, Bodsworth, N, Mindel A et al. An update on short-course episodic and prevention therapies for herpes genitalis. Herpes 2007; 14 (Suppl. 1):5A.
16 - Kudesia, G. e Wreighitt,T. (2009). Clinical and Dignostic Virology.CambridgeUniversity Press, Cambridge.
17 - Duque V, Malcata L, Serra E et al. Doenças infecciosas: o desafio daclínica. 2008; 53-56,130-131.
18 - Fatahzadeh M. e Schwartz, R. (2007). Human Herpes Simplex Virus Infections:Epidemiology, Pathogenesis, Symptomatology, Diagnosis and Management. AmericanAcademy of Dermatology, Inc.,57, pp. 737-761.
19 - Veronesi R, Focaccia R. Tratado de Infectologia. 1997; 25:85-399.