A avaliação da proteinúria na Pré-Eclâmpsia
Quinta, 05 Abril 2018 12:29
Introdução
Em 1843, o obstetra John Lever, do Guy’s Hospital em Londres, descreveu a presença de proteinúria em gestantes com hipertensão. O intuito foi diferenciar essas pacientes de portadoras de Doença de Bright, uma forma de nefrite descrita na época, associada a hipertensão, proteinúria e cardiopatia.1 Acredita-se atualmente que a Doença de Bright tratava-se de nefropatia diabética.
Ao demonstrar a proteinúria relacionada a uma alteração renal específica da gravidez, a pré-eclâmpsia/eclâmpsia, Lever apontou uma forma de acompanhamento dessas pacientes que se tornou clássica e seguida por todos até os dias atuais.
A demonstração da proteinúria em gestantes com pré-eclâmpsia/eclâmpsia também marcou o início de uma série de estudos sobre lesões glomerulares associadas ao problema, mas foi somente em 1976, que Spargo cunhou o termo Glomeruloendoteliose como lesão característica da pré-eclâmpsia.2
Atualmente, ainda que se admita que a lesão seja realmente característica da pré-eclâmpsia, não deve ser vista como patognomônica da mesma. Ademais, outras alterações, relacionadas até mesmo com maior gravidade, podem se instalar na pré-eclâmpsia, como é o caso da Glomeruloesclerose Segmentar Focal.3
Ainda que as observações de lesões glomerulares pudessem justificar a presença de proteinúria na pré-eclâmpsia, sua real fisiopatologia só passou a ser compreendida recentemente, estando relacionada à presença de grande quantidade de fatores anti-angiogênicos, principalmente o sFlt-1 (soluble fms-like Tyrosine Kinase-1), na circulação de mulheres com pré-eclâmpsia.
O sFlt-1 é produzido principalmente pela placenta preeclâmptica e ao ser liberado da circulação, age interceptando moléculas de fatores angiogênicos, como o fator de crescimento placentário (do inglês, PlGF) e o fator de crescimento vásculo endotelial (do inglês, VEGF), impedindo que essas moléculas realizem a homeostase endotelial e culminando então com a lesão endotelial sistêmica observada na pré-eclâmpsia.4
A participação do sFlt-1 no desenvolvimento da proteinúria é demonstrada na figura 1. O glomérulo possui, entre as suas estruturas, os podócitos, situados sobre a membrana basal. Essas estruturas são responsáveis pela secreção de moléculas de VEGF, responsáveis pela homeostase do endotélio glomerular5.
As elevadas concentrações de sFlt-1 nas pacientes com pré-eclâmpsia agem interceptando o VEGF produzido localmente, impedindo que o mesmo desempenhe suas funções ao ligar-se às células endoteliais.
Assim, o endotélio glomerular lesado (Glomeruloendoteliose) torna-se edemaciado e sofre alargamento de suas fenestras, perdendo sua capacidade de contenção das moléculas proteicas, passando a excretá-las em quantidades variadas na urina das pacientes com pré-eclâmpsia.
Há ainda, a lesão e perda das estruturas podocitárias, que também podem ser encontradas na urina de pacientes com pré-eclâmpsia - podocitúria.
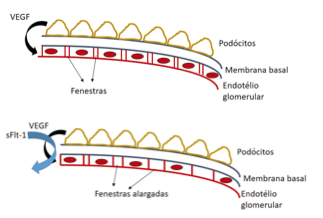
Figura 1. Representação do papel do sFlt-1 na fisiopatologia da proteinúria na pré-eclâmpsia.
A proteinúria no diagnóstico da pré-eclâmpsia
Por muito tempo a pré-eclâmpsia foi diagnosticada a partir da tríade hipertensão arterial, edema e proteinúria. Em 2000, uma avaliação feita por um grupo de especialistas que compunham o National High Blood Pressure Education Program considerou que o edema não deveria mais ser considerado para o diagnóstico da doença, uma vez que essa é uma alteração comum na fisiologia da gravidez, mantendo-se porém, hipertensão e proteinúria como critérios diagnósticos.6
Novamente, uma revisão de especialistas, agora compondo o Task Force on Hypertension in Pregnancy - American College of Obstetrics and Gynecology, considerou que a presença da proteinúria é dispensável no diagnóstico da pré-eclâmpsia se a paciente já apresentar níveis pressóricos que caracterizem comprometimento de órgãos alvos.7 A International Society for the Study of Hypertension acrescenta a presença de insuficiência/disfunção placentária. 8 O quadro 1 reúne esses critérios, sendo que esta comissão é favorável ao seu uso para o diagnóstico da pré-eclâmpsia.8
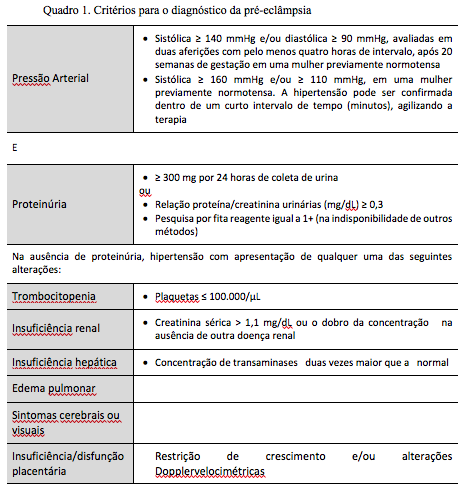
Assim, pacientes apresentando níveis pressóricos considerados como não graves após a vigésima semana de gestação e sem comprometimento de órgãos alvos ou sinais de comprometimento placentário são diagnosticadas com hipertensão gestacional e não como pré-eclâmpsia. O que, de forma alguma, afasta a possibilidade de que essas mesmas pacientes evoluam com quadros de pré-eclâmpsia ao longo das próximas semanas, não devendo-se portanto reduzir a importância e o acompanhamento dessas pacientes.
Entendemos que os objetivos principais das novas orientações para o diagnóstico da pré-eclâmpsia é evitar atrasos no mesmo e lembrar os responsáveis pelo atendimento dessas pacientes de que a assistência adequada deve ser prontamente instituída sempre.
Quantificação da proteinúria e seu uso como critério prognóstico
O padrão ouro na determinação da proteinúria continua sendo o exame da urina de 24 horas. Perdas maiores ou iguais a 300mg de proteína em 24h são indicativas de pré-eclâmpsia. A relação proteína/creatinina (P/C) urinárias (medidas em mg/dL) mostra boa correlação com a proteinúria de 24 horas e pode ser utilizada em substituição desta por ter a vantagem de proporcionar um resultado mais rápido.
Estudos que comparam pontos de corte para a P/C com os níveis encontrados em proteinúria de 24h demonstram que uma relação de P/C = 0,3 possui sensibilidade em torno de 87% para o diagnóstico de proteinúria de 24h ≥ 300 mg.7 Assim, a relação P/C = 0,3 é atualmente recomendada para o diagnóstico de proteinúria significativa em pacientes com suspeita de PE. 9 É importante ressaltar que valores maiores do que 0,7 indicam a presença de proteinúria em níveis nefróticos.
Seguindo a ideia de se chegar a pontos de corte para a utilização da relação P/C urinárias em substituição à proteinúria de 24h, uma revisão sistemática demonstrou que valores da relação P/C inferiores a 0,15 afastam a presença de proteinúria ≥ 300mg/24h em 99% das vezes.10 Valores intermediários devem, portanto, ser confirmados pela proteinúria de 24h.
A proteinúria de amostra isolada é menos confiável para ser utilizada como método diagnóstico de proteinúria significativa.6 Porém, a utilização de avaliações como proteinúria de fita é recomendada na prática clínica diária, tanto em ambiente de pronto atendimento quanto em ambulatórios pré-natais, especialmente em locais de menores recursos financeiros.
Portanto, ao nos deparamos com uma gestante apresentando elevações de pressão arterial (em níveis não graves) e proteinúria +, recomenda-se a sua internação para melhor avaliação. Torna-se importante ressaltar que o resultado negativo do exame de fita não exclui a presença de proteinúria.
A utilização da quantificação da proteinúria no prognóstico da evolução da pré-eclâmpsia passou a receber críticas nos últimos anos. Tal consideração, seguramente apareceu devido a utilização de níveis de proteinúria como critério isolado para se indicar a realização do parto em pacientes com pré-eclâmpsia, contribuindo para o aumento das taxas de prematuridade relacionadas à doença.
Um estudo antigo que acompanhou 66 gestantes com pré-eclâmpsia grave admitidas para conduta conservadora, observou que embora o valor da proteinúria tendesse a aumentar em algumas pacientes, esse aumento não se relacionou a pior prognóstico materno e fetal, quando comparado a pacientes em que a proteinúria se mantinha estável.11
Outro estudo comparou os resultados maternos e perinatais de 125 pacientes com proteinúria menor que 5g/24h com 43 pacientes com proteinúria entre 5 e 10g/24h e 41 pacientes com proteinúria maior que 10g/24h. Eles concluíram que apesar da proteinúria maciça (> 10g/24h) ser mais frequente nas pacientes graves e de início precoce, o valor isolado da proteinúria não associou-se a piores resultados.12
Em função de tais achados, a Task Force on Hypertension in Pregnancy, considerou que o valor inicial ou a taxa de mudança da proteinúria não deveriam ser considerados como critérios para evitar ou suspender a conduta conservadora na pré-eclâmpsia precoce.7 Mais recentemente, Mateus et al. (2017) voltaram a chamar a atenção para os níveis de proteinúria massiva como associados a complicações maternas.13
A CNE de hipertensão da FEBRASGO admite a importância da proteinúria e ressalta que é evidente que pacientes com níveis elevados de proteinúria (>2g/24h) e principalmente aquelas com proteinúria maciça (>10g/24h) têm maiores riscos de desfechos adversos, tanto maternos quanto perinatais. Assim, recomendamos que essas pacientes sejam mantidas internadas e em constante acompanhamento e controle adequado dos seus níveis pressóricos, procurando-se ao máximo evitar a resolução da gestação de maneira intempestiva, baseada exclusivamente nos níveis de proteinúria.
Referências
Em 1843, o obstetra John Lever, do Guy’s Hospital em Londres, descreveu a presença de proteinúria em gestantes com hipertensão. O intuito foi diferenciar essas pacientes de portadoras de Doença de Bright, uma forma de nefrite descrita na época, associada a hipertensão, proteinúria e cardiopatia.1 Acredita-se atualmente que a Doença de Bright tratava-se de nefropatia diabética.
Ao demonstrar a proteinúria relacionada a uma alteração renal específica da gravidez, a pré-eclâmpsia/eclâmpsia, Lever apontou uma forma de acompanhamento dessas pacientes que se tornou clássica e seguida por todos até os dias atuais.
A demonstração da proteinúria em gestantes com pré-eclâmpsia/eclâmpsia também marcou o início de uma série de estudos sobre lesões glomerulares associadas ao problema, mas foi somente em 1976, que Spargo cunhou o termo Glomeruloendoteliose como lesão característica da pré-eclâmpsia.2
Atualmente, ainda que se admita que a lesão seja realmente característica da pré-eclâmpsia, não deve ser vista como patognomônica da mesma. Ademais, outras alterações, relacionadas até mesmo com maior gravidade, podem se instalar na pré-eclâmpsia, como é o caso da Glomeruloesclerose Segmentar Focal.3
Ainda que as observações de lesões glomerulares pudessem justificar a presença de proteinúria na pré-eclâmpsia, sua real fisiopatologia só passou a ser compreendida recentemente, estando relacionada à presença de grande quantidade de fatores anti-angiogênicos, principalmente o sFlt-1 (soluble fms-like Tyrosine Kinase-1), na circulação de mulheres com pré-eclâmpsia.
O sFlt-1 é produzido principalmente pela placenta preeclâmptica e ao ser liberado da circulação, age interceptando moléculas de fatores angiogênicos, como o fator de crescimento placentário (do inglês, PlGF) e o fator de crescimento vásculo endotelial (do inglês, VEGF), impedindo que essas moléculas realizem a homeostase endotelial e culminando então com a lesão endotelial sistêmica observada na pré-eclâmpsia.4
A participação do sFlt-1 no desenvolvimento da proteinúria é demonstrada na figura 1. O glomérulo possui, entre as suas estruturas, os podócitos, situados sobre a membrana basal. Essas estruturas são responsáveis pela secreção de moléculas de VEGF, responsáveis pela homeostase do endotélio glomerular5.
As elevadas concentrações de sFlt-1 nas pacientes com pré-eclâmpsia agem interceptando o VEGF produzido localmente, impedindo que o mesmo desempenhe suas funções ao ligar-se às células endoteliais.
Assim, o endotélio glomerular lesado (Glomeruloendoteliose) torna-se edemaciado e sofre alargamento de suas fenestras, perdendo sua capacidade de contenção das moléculas proteicas, passando a excretá-las em quantidades variadas na urina das pacientes com pré-eclâmpsia.
Há ainda, a lesão e perda das estruturas podocitárias, que também podem ser encontradas na urina de pacientes com pré-eclâmpsia - podocitúria.

Figura 1. Representação do papel do sFlt-1 na fisiopatologia da proteinúria na pré-eclâmpsia.
A proteinúria no diagnóstico da pré-eclâmpsia
Por muito tempo a pré-eclâmpsia foi diagnosticada a partir da tríade hipertensão arterial, edema e proteinúria. Em 2000, uma avaliação feita por um grupo de especialistas que compunham o National High Blood Pressure Education Program considerou que o edema não deveria mais ser considerado para o diagnóstico da doença, uma vez que essa é uma alteração comum na fisiologia da gravidez, mantendo-se porém, hipertensão e proteinúria como critérios diagnósticos.6
Novamente, uma revisão de especialistas, agora compondo o Task Force on Hypertension in Pregnancy - American College of Obstetrics and Gynecology, considerou que a presença da proteinúria é dispensável no diagnóstico da pré-eclâmpsia se a paciente já apresentar níveis pressóricos que caracterizem comprometimento de órgãos alvos.7 A International Society for the Study of Hypertension acrescenta a presença de insuficiência/disfunção placentária. 8 O quadro 1 reúne esses critérios, sendo que esta comissão é favorável ao seu uso para o diagnóstico da pré-eclâmpsia.8

Assim, pacientes apresentando níveis pressóricos considerados como não graves após a vigésima semana de gestação e sem comprometimento de órgãos alvos ou sinais de comprometimento placentário são diagnosticadas com hipertensão gestacional e não como pré-eclâmpsia. O que, de forma alguma, afasta a possibilidade de que essas mesmas pacientes evoluam com quadros de pré-eclâmpsia ao longo das próximas semanas, não devendo-se portanto reduzir a importância e o acompanhamento dessas pacientes.
Entendemos que os objetivos principais das novas orientações para o diagnóstico da pré-eclâmpsia é evitar atrasos no mesmo e lembrar os responsáveis pelo atendimento dessas pacientes de que a assistência adequada deve ser prontamente instituída sempre.
Quantificação da proteinúria e seu uso como critério prognóstico
O padrão ouro na determinação da proteinúria continua sendo o exame da urina de 24 horas. Perdas maiores ou iguais a 300mg de proteína em 24h são indicativas de pré-eclâmpsia. A relação proteína/creatinina (P/C) urinárias (medidas em mg/dL) mostra boa correlação com a proteinúria de 24 horas e pode ser utilizada em substituição desta por ter a vantagem de proporcionar um resultado mais rápido.
Estudos que comparam pontos de corte para a P/C com os níveis encontrados em proteinúria de 24h demonstram que uma relação de P/C = 0,3 possui sensibilidade em torno de 87% para o diagnóstico de proteinúria de 24h ≥ 300 mg.7 Assim, a relação P/C = 0,3 é atualmente recomendada para o diagnóstico de proteinúria significativa em pacientes com suspeita de PE. 9 É importante ressaltar que valores maiores do que 0,7 indicam a presença de proteinúria em níveis nefróticos.
Seguindo a ideia de se chegar a pontos de corte para a utilização da relação P/C urinárias em substituição à proteinúria de 24h, uma revisão sistemática demonstrou que valores da relação P/C inferiores a 0,15 afastam a presença de proteinúria ≥ 300mg/24h em 99% das vezes.10 Valores intermediários devem, portanto, ser confirmados pela proteinúria de 24h.
A proteinúria de amostra isolada é menos confiável para ser utilizada como método diagnóstico de proteinúria significativa.6 Porém, a utilização de avaliações como proteinúria de fita é recomendada na prática clínica diária, tanto em ambiente de pronto atendimento quanto em ambulatórios pré-natais, especialmente em locais de menores recursos financeiros.
Portanto, ao nos deparamos com uma gestante apresentando elevações de pressão arterial (em níveis não graves) e proteinúria +, recomenda-se a sua internação para melhor avaliação. Torna-se importante ressaltar que o resultado negativo do exame de fita não exclui a presença de proteinúria.
A utilização da quantificação da proteinúria no prognóstico da evolução da pré-eclâmpsia passou a receber críticas nos últimos anos. Tal consideração, seguramente apareceu devido a utilização de níveis de proteinúria como critério isolado para se indicar a realização do parto em pacientes com pré-eclâmpsia, contribuindo para o aumento das taxas de prematuridade relacionadas à doença.
Um estudo antigo que acompanhou 66 gestantes com pré-eclâmpsia grave admitidas para conduta conservadora, observou que embora o valor da proteinúria tendesse a aumentar em algumas pacientes, esse aumento não se relacionou a pior prognóstico materno e fetal, quando comparado a pacientes em que a proteinúria se mantinha estável.11
Outro estudo comparou os resultados maternos e perinatais de 125 pacientes com proteinúria menor que 5g/24h com 43 pacientes com proteinúria entre 5 e 10g/24h e 41 pacientes com proteinúria maior que 10g/24h. Eles concluíram que apesar da proteinúria maciça (> 10g/24h) ser mais frequente nas pacientes graves e de início precoce, o valor isolado da proteinúria não associou-se a piores resultados.12
Em função de tais achados, a Task Force on Hypertension in Pregnancy, considerou que o valor inicial ou a taxa de mudança da proteinúria não deveriam ser considerados como critérios para evitar ou suspender a conduta conservadora na pré-eclâmpsia precoce.7 Mais recentemente, Mateus et al. (2017) voltaram a chamar a atenção para os níveis de proteinúria massiva como associados a complicações maternas.13
A CNE de hipertensão da FEBRASGO admite a importância da proteinúria e ressalta que é evidente que pacientes com níveis elevados de proteinúria (>2g/24h) e principalmente aquelas com proteinúria maciça (>10g/24h) têm maiores riscos de desfechos adversos, tanto maternos quanto perinatais. Assim, recomendamos que essas pacientes sejam mantidas internadas e em constante acompanhamento e controle adequado dos seus níveis pressóricos, procurando-se ao máximo evitar a resolução da gestação de maneira intempestiva, baseada exclusivamente nos níveis de proteinúria.
Referências
- Karumanchi SA, Lindheimer MD. Preeclampsia and the kidney: footprints in the urine. Am J Obstet Gynecol. 2007;196(4):287-8.
- Oliveira LG, Sass N, Camano L, Moura LAR, Bergamin Alterações glomerularesna pré-eclâmpsia - uma revisão histórica. Femina;32(10):865-869.
- Kwiatkowski S, Kwiatkowska E, Rzepka R, Kurkiewicz V, Mikołajek-Bedner W, Torbè A. Development of a focal segmental glomerulosclerosis after pregnancy complicated by preeclampsia: case report and review of literature. J Matern Fetal Neonatal Med.2016;29(10):1566-9.
- De Oliveira LG, Karumanchi A, Sass N. Preeclampsia: oxidative stress, inflammation and endothelial dysfunction. Rev Bras Ginecol Obstet.2010;32(12):609-16.
- Hladunewich M, Karumanchi SA, Lafayette R. Pathophysiology of the clinical manifestations of preeclampsia. Clin J Am Soc Nephrol. 2007; 2: 543-9.
- Report of the National High Blood Pressure Education ProgramWorking Group on High Blood Pressure in Pregnancy. Am J Obstet Gynecol. 2000;183(1):S1-S22.
- American College of Obstetricians and Gynecologists. Task Force on Hypertension in Pregnancy. ACOG Hypertension in Pregnancy Task Force. Washington, DC: American College of Obstetricians and Gynecologists; 2013.
- Tranquilli AL, Dekker G, Magee L, Roberts J, Sibai BM, Steyn W, Zeeman GG, Brown MA. The classification, diagnosis and management of the hypertensive disorders of pregnancy: A revised statement from the ISSHP. Pregnancy Hypertens.2014;4(2):97-104.
- Wheeler TL 2nd, Blackhurst DW, Dellinger EH, Ramsey PS. Usage of spot urine protein to creatinine ratios in the evaluation of preclampsia. Am J Obstet Gynecol. 2007; 196: 456 e1-4.
- Papanna R, Mann LK, Kouides RW, Glantz JC. Protein/creatinine ratio in preeclampsia: a systematic review. Obstet Gynecol. 2008; 112: 135-44.
- Schiff E, Friedman SA, Kao L, Sibai BM. The importance of urinary protein excretion during conservative management of severe preeclampsia. Am J Obstet Gynecol. 1996; 175: 1313-6.
- Newman MG, Robichaux AG, Stedman CM, Jaekle RK, Fontenot MT, Dotson T, Lewis DF. Perinatal outcomes in preeclampsia that is complicated by massive proteinuria. Am J Obstet Gynecol. 2003; 188: 264-8.
- Mateus J, Newman R, Sibai BM, Li Q, Barton JR, Combs CA, et al. Massive Urinary Protein Excretion Associated with Greater Neonatal Risk in Preeclampsia. AJP Rep. 2017;7(1):e49-e58.






