Infecção Urinária de Repetição-Aspectos atuais
Sexta, 16 Março 2018 15:39
Rafael Mendes Moroni1,2; Luiz Gustavo Oliveira Brito3
1 Professor Assistente da Disciplina de Ginecologia e Obstetrícia – Universidade Estadual do Oeste do Paraná
2 Doutorando do Programa de Pós-Graduação em Ginecologia e Obstetrícia; Faculdade de Medicina de Ribeirão Preto – Universidade de São Paulo
3 Professor Doutor do Departamento de Tocoginecologia - Universidade Estadual de Campinas
Introdução
Infecções do trato urinário (ITUs) correspondem à presença de microorganismos patogênicos nas vias urinárias inferiores ou superiores. São frequentemente consideradas um dos subtipos mais comuns de infecção bacteriana em humanos (Foxman 2003). Tais infecções podem acometer o trato urinário baixo, manifestando-se como uretrites e cistites, ou alto, manifestando-se como pielonefrites. As ITUs são mais frequentes nas mulheres, em comparação aos homens, e se estima que cerca de metade das mulheres terão ao menos um episódio de ITU ao longo da vida (Griebling 2005). Um número bem mais restrito de mulheres desenvolve quadros cronicamente recorrentes de ITUs, dando origem à condição conhecida como ITU recorrente, ou ITU de repetição, que é definida pela International Continence Society / International Urogynecology Association como o diagnóstico de três episódios de infecção no curso de 12 meses, ou dois episódios em seis meses, com demonstração objetiva de resolução de cada um dos episódios após tratamento (Haylen et al. 2010). Uma coorte de base populacional norte-americana, com duração de 9 anos, estimou uma incidência de ITUs recorrentes não complicadas de 102 em 100.000 mulheres, ou cerca de 0,1%, com predomínio nas faixas etárias entre 18 a 34 anos, e entre 55 a 64 anos (Suskind et al. 2016). Apesar de tais episódios serem geralmente leves e auto-limitados, eles podem determinar um prejuízo significativo na qualidade de vida dessas mulheres, com irritabilidade, perda de produtividade no trabalho, perda de auto-estima e comprometimento da função sexual (Boeri et al. 2017).
Etiologia e Fisiopatologia
Múltiplos microorganismos podem ser responsáveis por ITUs, tais como Klebsiella spp., Pseudomonas spp., Enterobacter spp., Serratia spp., Klebsiella spp., Proteus spp. e Enterococcus spp (Boeri et al. 2017). Sabe-se porém, que a bactéria mais frequentemente associada a tais infecções é a Escherichia coli, responsável por 60 a 80% dos casos (Kahlmeter 2003). E.coli é um microorganismo normal da flora intestinal humana, sendo que a maior parte das cepas não possui capacidade de produzir doença. Algumas cepas, porém, são virulentas, responsáveis por infecções intestinais invasivas, ou por infecções extra-intestinais, como é o caso das E. coli uropatogênicas (UPEC) associadas aos quadros de ITU (Bien et al. 2012). Considerando a curta distância entre o ânus e o meato uretral externo feminino, mulheres que possuem cepas UPEC de E.coli em sua microbiota intestinal podem disseminar tais microorganismos ao períneo e introito vaginal, permitindo a ascensão dos mesmos ao trato urinário inferior. Quando tal disseminação acontece, essas bactérias aderem à mucosa do trato urinário através de estruturas denominadas fímbrias, que possuem papel importante como determinantes da virulência das cepas UPEC (Bower et al. 2005). O turnover celular acelerado da superfície da mucosa do trato urinário, com esfoliação celular, e o próprio fluxo urinário consistem em mecanismos de defesa contra a aderência de tais bactérias à superfície mucosa, impedindo que a ascensão das mesmas determine um quadro de infecção. Quando, porém, tais mecanismos não são capazes de remover as bactérias aderidas, pode haver invasão da superfície mucosa pelos microorganismos, com estabelecimento de um processo infeccioso invasivo. Apesar de classicamente ser considerada uma infecção extracelular, mais recentemente tem-se reconhecido a capacidade das UPECs de invadirem as células uroteliais e estabelecerem uma colonização intracelular crônica, que resiste aos mecanismos de defesa inatos e mesmo ao tratamento com antimicrobianos, e se associa com quadros recorrentes de ITU (Bower et al. 2005).
Fatores de Risco
Como mencionado previamente, mulheres já estão sob risco mais elevado para o desenvolvimento de ITUs, e isso se relaciona às características anatômicas do trato genito-urinário feminino. A proximidade entre ânus e uretra e o fato de a uretra feminina ser mais curta que a masculina contribui para um maior risco de uropatógenos ascenderem ao trato urinário inferior (Yamamoto et al. 1997).
Além disso, diversos outros fatores de risco estão relacionados ao desenvolvimento de ITUs, especialmente de quadros recorrentes.
Por definição, quadros recorrentes de ITU necessitam de comprovação microbiológica através de urocultura (Haylen et al. 2010). Outras investigações, porém, não são recomendadas de forma rotineira para a maioria dessas mulheres, devido à baixa custo-efetividade e baixa utilidade diagnóstica. Apesar disso, sabe-se que a presença de anomalias estruturais, corpos estranhos no trato urinário, e urolitíase podem estar associados a quadros recorrentes de ITU, e tais condições podem ser potencialmente detectadas e tratadas. Sendo assim, investigação urológica utilizando exames de imagem (incluindo urografia excretora, tomografia computadorizada e ultrassonografia de rins e vias urinárias) e cistoscopia podem ser indicados de maneira individualizada, se houver suspeita de alguma dessas condições (Chew 1999). Em um estudo retrospectivo envolvendo 163 mulheres com ITU de repetição submetidas a investigação urológica complementar, apenas 5,5% apresentaram algum achado anormal (incluindo divertículo vesical, estenose uretral e presença de sutura na bexiga); tal amostra, porém, continha uma proporção significativa de mulheres já submetidas a cirurgias uroginecológicas e a transplante renal, e a proporção de achados positivos deve ser possivelmente inferior em mulheres que não possuem tais fatores de risco (Pagano et al. 2017). A urodinâmica não contribui na elucidação da causa da ITU de repetição.
Estratégias para Prevenção
Uma série de possíveis medidas e tratamentos pode ser instituída em mulheres que apresentam quadros recorrentes de ITU, incluindo medidas comportamentais e uma série de agentes.
Escolha de método contraceptivo
O uso de diafragma, capuz cervical e espermicidas (mesmo preservativos masculinos contendo espermicidas) eleva o risco de ITU recorrente. Mulheres com tais quadros e que utilizam tais métodos podem discutir métodos alternativos de contracepção (Hooton et al. 1996).
Hábitos de higiene e micção
Apesar de a evidência ser limitada, a realização de higiene perineal e micção precocemente após o coito, além da ingesta abundante de líquidos visando aumentar o débito urinário, pode contribuir para redução do risco (Scholes et al. 2000).
Antibióticos
O uso de antimicrobianos em regimes de profilaxia, ou o tratamento auto-administrado pela mulher ao sentir os primeiros sintomas de uma ITU, são possíveis modalidades de manejo utilizando antibióticos. É importante dizer que não existem trabalhos com mais de seis meses de antibioticoprofilaxia mostrando qual deverá ser a sequencia de tratamento mais adequada após o primeiro tratamento.
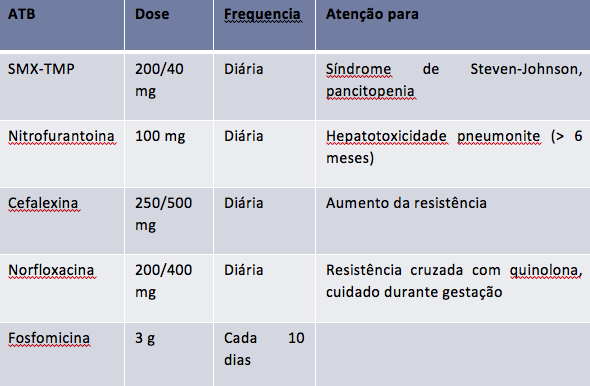
O uso de regimes contínuos, diários, de profilaxia já foi extensamente estudado por inúmeros estudos controlados, utilizando diferentes antibióticos (nitrofurantoína, sulfametoxazol-trimpetoprim, norfloxacino), comparados entre si e com placebo (Nicolle et al. 1989; Brumfitt & Smith 1985; Stamm et al. 1980), e demonstram excelente eficácia em reduzir a incidência de recorrências quando comparados ao placebo. Uma meta-analise da fundação Cochrane envolvendo 10 ensaios controlados e 430 mulheres (Albert et al. 2004), comparando múltiplos antibióticos versus placebo, demonstrou um redução de quase 80% [RR = 0,21 (IC95% 0,13 a 0,34)] para um episódio de recorrência microbiológica no grupo antibiótico. A recorrência clínica também foi significativamente reduzida com antibiótico. Por outro lado, os grupos que utilizaram antimicrobianos apresentaram maior incidência de efeitos adversos, incluindo candidíase genital e sintomas gastrointestinais. Na comparação entre os diversos antibióticos, individualmente, não se obteve evidência de superioridade de nenhum dos agentes. Tem sido dada preferência do uso à nitrofurantoína para essa indicação, devido ao perfil desse agente de atingir concentrações clinicamente significativas somente no trato urinário, tendo, teoricamente, menor potencial de interferir com a microbiota de outros órgãos, como o intestino e a vagina (Price et al. 2016). O uso de nitrofurantoína por períodos muito prolongados, porém, pode se associar a fibrose pulmonar e a hepatotoxicidade, especialmente em pacientes com insuficiência renal e clearance de creatinina inferior 30mL/min (Oplinger & Andrews 2013). Além dos efeitos adversos, outro problema associado a profilaxia contínua com antibióticos é o potencial de desenvolvimento resistência microbiana ao agente utilizado, o que já foi observado em estudos com sulfametoxazol-trimetoprim (SMX-TMP) e com ciprofloxacino (Melekos et al. 1997; Nicolle et al. 1988). O tempo de uso de regimes contínuos de profilaxia é motivo de controvérsia; alguns autores sugerem o uso por seis meses, seguido de um período de observação sem antibióticos, mas períodos mais prolongados, de até cinco anos, já foram estudados, e podem ser utilizados em mulheres que retomam os quadros de infecções recorrentes após suspensão do regime de profilaxia (Nicolle et al. 1988).
Para mulheres em que se observa uma relação entre os quadros recorrentes de ITU e a atividade sexual, uma alternativa ao uso contínuo de antibioticoprofilaxia é a administração desses agentes após o coito, em um regime de profilaxia pós coital. Um estudo comparando a profilaxia pós-coital com ciprofloxacino 125mg versus uso contínuo da mesma dose diária observou redução comparável na incidência de ITUs sintomáticas (De 3,6 e 3,7 ITUs por paciente-ano para 0,46 e 0,42 ITUs por paciente-ano nos grupos de profilaxia pós-coital e contínua, respectivamente) (Melekos et al. 1997). Na comparação com placebo, SMX-TMP em regime pós coital foi significativamente melhor em reduzir a incidência dos quadros de infecção em outro estudo controlado (com 3,6 e 0,3 ITUs por paciente-ano nos grupos placebo e profilaxia pós-coital, respectivamente) (Stapleton et al. 1990). Resumindo, não há diferença de eficácia entre a profilaxia contínua e a de pós-coito.
Outra estratégia para minimizar a exposição aos antimicrobianos e o impacto sobre a resistência bacteriana é o auto-tratamento, mediante o reconhecimento, pela mulher, dos sintomas sugestivos de um novo quadro de ITU. Já se demonstrou uma acurácia de 85% a 95% para o auto-diagnóstico de ITU pela mulher, com base em seus sintomas (Gupta & Hooton 2001). A orientação médica é especialmente importante nesta estratégia, para que a mulher seja aderente às instruções e procure assistência em casos de persistência.
Cranberry
Existe evidência experimental de longa data demonstrando, in vitro, que extratos de cranberry reduzem a capacidade das E. coli uropatogênicas aderirem ao epitélio urotelial. O efeito clínico de tal propriedade, porém, é motivo de controvérsia. Alguns ensaios clínicos randomizados que compararam o uso de produtos derivados de cranberry (suco ou capsulas) com placebo demonstraram redução na incidência de novos episódios de ITU e de bacteriúria / piúria (Maki et al. 2016; Stothers 2002; Kontiokari et al. 2001). Por outro lado, outros ensaios randomizados com comparações semelhantes não observaram diferença entre os grupos, sendo o número de recorrência observadas com o cranberry equivalente às do placebo (Barbosa-Cesnik et al. 2011; Stapleton et al. 2012). Mesmo meta-análises de ensaios randomizados não apresentam resultados consistentes. Uma revisão sistematizada com meta-análise demonstrou benefício em mulheres com ITUs recorrentes (RR = 0,53, IC95% 0,33-0,83), mas com elevada heterogeneidade clínica entre os ensaios (diferentes doses, diferentes produtos de cranberry, diferentes definições de ITU) (Wang & Fang 2012). Já uma outra revisão sistematizada com meta-análise, da fundação Cochrane, incluindo um maior número de estudo e agregando mais participantes (24 estudos e 4473 mulheres) não demonstrou diferença significativa entre cranberry e nenhum tratamento ou placebo (RR = 0,86, IC95% 0,71 a 1,04) (Jepson et al. 2012).
Não há evidência definitiva para se recomendar o uso de cranberry como tratamento eficaz em substituição aos antibióticos para mulheres com ITU de repetição, apesar de haver um mecanismo de ação plausível, e de vários ensaios clínicos sugerirem benefício. Por outro lado, em mulheres que desejem tentar tratamentos que não envolvam antimicrobianos, provavelmente os riscos e potenciais efeitos adversos são escassos e não haveria um malefício no seu uso.
Terapia hormonal tópica
Em mulheres menopausadas com quadros de ITU recorrente, o uso de terapia tópica com estrogênio é considerado eficaz em reduzir o risco de recorrências. O hormônio tópico reestabelece a flora vaginal normal, com redução do pH vaginal e menor potencial de colonização por enterobactérias (Stamm 2007).
Lactobacilos
O uso de probióticos, especialmente contendo lactobacilos, foi estudado devido ao potencial desses agentes de manter um pH vaginal reduzido, de reduzir a adesividade dos uropatógenos, e de produzir peróxido de hidrogênio, que pode eliminar enterobactérias do meio vaginal. Dentre quatro ensaios clínicos randomizados estudando o uso de lactobacilos administrados através de cápsulas vaginais, não se observou diferença significativa em comparação a placebo e a extrato lácteo em três desses estudos (Baerheim et al. 1994; Reid et al. 1992; Kontiokari et al. 2001); no quarto estudo, que comparou lactobacilos com fator de crescimento de lactobacilos (que teria a função de estimular a replicação da microbiota vaginal normal), também não se observou diferença entre as duas intervenções, mas os autores afirmam que houve uma incidência 73% menor em ambos os grupos em comparação aos 12 meses antes das intervenções (de 6 episódios por paciente-ano para 1,6 e 1,3 para os grupos lactobacilo e fator de crescimento, respectivamente) (Reid et al. 1995)
A evidência é escassa e insuficiente para permitir uma recomendação quanto à eficácia do uso de lactobacilos vaginais para a prevenção de ITUs. Os riscos associados a tal intervenção, no entanto, são muito escassos, sendo apenas relatados episódios de bacteremia por probióticos em pacientes gravemente imunossuprimidos (Barrons & Tassone 2008).
Imunoestimulantes
O uso de um extrato proveniente de 18 sorotipos de E.coli inativados por calor, denominado OM-89, é capaz de estimular tanto a imunidade inata quanto a adquirida, resultando em maior recrutamento de neutrófilos e células dendríticas, e na produção de imunoglobulinas G e A, específicas para os antígenos presentes no extrato de E.coli. Tal composto foi estudado por múltiplos ensaios clínicos, e uma meta-análise incluindo 4 estudos e 891 mulheres demonstrou uma redução significativa no número de recorrências (RR = 0,61, IC95% 0,48 a 0,78) em comparação a placebo. Além disso, não foram observados efeitos adversos significativos em comparação ao placebo (Beerepoot et al. 2013).
Um lisado via vaginal (formato de supositório) de seis cepas de E. coli, uma cepa de Proteus, Morganella, K. pneumoniae e E. faecalis está em teste. Aparentemente, mostrou um maior tempo de reinfecção do que no placebo e menor incidência da ITU nas primeiras 4 semanas, porém sem diferença com 20 semanas. Um segundo estudo com uma dose de reforço após primeira aplicação diminuiu infecção (Hopkins et al. 2007)
Conclusões
Infecções do trato urinário recorrentes podem ter um impacto significativo sobre a qualidade de vida das mulheres afetadas. Inúmeros fatores de risco são conhecidos, e alguns deles são modificáveis e/ou tratáveis, como comportamento sexual, uso de diafragmas e atrofia urogenital. Para aquelas mulheres que mantêm quadros recorrentes mesmo com medidas comportamentais e com tratamento da atrofia associada à menopausa, uma série de outras intervenções pode ser tentada, sendo o uso de antibióticos de forma profilática a mais extensamente estudada. Alternativas ao uso de anti-microbianos, tais como o consumo de cranberry e o uso de probióticos contendo lactobacilos podem ser tentadas, mas a evidência acerca da eficácia das mesmas é inconsistente. Por outro lado, o uso do OM-89 como imunoestimulante é mais eficaz que o placebo e comprovadamente reduz recorrências, sendo uma boa estratégia em pacientes com ITUs recorrentes por E.coli que não desejam utilizar antibióticos, ou quando os mesmos não forem eficazes.
Referências
Albert, X., Huertas, I. & Pereiró, I., 2004. Antibiotics for preventing recurrent urinary tract infection in non-pregnant women. Cochrane Database Syst Rev, p.CD001209.
Badran, Y.A. et al., 2015. Impact of genital hygiene and sexual activity on urinary tract infection during pregnancy. Urology Annals, 7(4), pp.478–481. Available at: https://www.scopus.com/inward/record.uri?eid=2-s2.0-84945955096&partnerID=40&md5=7d8315dd8acf6cca9d01fe9c05e779ad.
Baerheim, A., Larsen, E. & Digranes, A., 1994. Vaginal application of Lactobacilli in the prophylaxis of recurrent lower urinary tract infection in women. Scand J Prim Health Care., 12, pp.239–43.
Barbosa-Cesnik, C. et al., 2011. Cranberry Juice Fails to Prevent Recurrent Urinary Tract Infection: Results From a Randomized Placebo-Controlled Trial. Clinical Infectious Diseases, 52(1), pp.23–30. Available at: http://cid.oxfordjournals.org//cgi/doi/10.1093/cid/ciq073 [Accessed December 9, 2010].
Barrons, R. & Tassone, D., 2008. Use of Lactobacillus probiotics for bacterial genitourinary infections in women: A review. Clinical Therapeutics, 30(3), pp.453–468.
Beerepoot, M.A.J. et al., 2013. Nonantibiotic prophylaxis for recurrent urinary tract infections: A systematic review and meta-analysis of randomized controlled trials. Journal of Urology, 190(6), pp.1981–1989. Available at: http://dx.doi.org/10.1016/j.juro.2013.04.142.
Bien, J., Sokolova, O. & Bozko, P., 2012. Role of uropathogenic escherichia coli virulence factors in development of urinary tract infection and kidney damage. International Journal of Nephrology, 2012.
Boeri, L. et al., 2017. Six Out of Ten Women with Recurrent Urinary Tract Infections Complain of Distressful Sexual Dysfunction – A Case-Control Study. Scientific Reports, 7(February), p.44380. Available at: http://www.nature.com/articles/srep44380.
Bower, J.M., Eto, D.S. & Mulvey, M.A., 2005. Covert operations of uropathogenic Escherichia coli within the Urinary Tract. Traffic, 6(1), pp.18–31.
Brumfitt, W. & Smith, G., 1985. A clinical comparison between Macrodantin and trimethoprim for prophylaxis in women with recurrent urinary infections. J Antimicrob Chemother, 16(1), pp.111–20.
Chew, L.F.S., 1999. Recurrent cystitis in nonpregnant women. West J Med, 170(5), pp.274–77.
Foxman, B., 2003. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs. Dis. Mon., 49(2), pp.53–70.
Griebling, T., 2005. Urologic diseases in America project: trends in resource use for urinary tract infections in women. The Journal of Urology, 173(4), pp.1281–7.
Gupta, K. & Hooton, T., 2001. Patient-initiated treatment of uncomplicated recurrent urinary tract infections in young women. Annals of internal medicine, pp.9–16. Available at: http://annals.org/article.aspx?articleid=714601.
Haylen, B.T. et al., 2010. An International Urogynecological Association (IUGA)/International Continence Society (ICS) joint report on the terminology for female pelvic floor dysfunction. International urogynecology journal, 21(1), pp.5–26. Available at: http://www.ncbi.nlm.nih.gov/pubmed/19937315 [Accessed May 21, 2013].
Haylen, B.T. et al., 2009. Recurrent urinary tract infections in women with symptoms of pelvic floor dysfunction. International Urogynecology Journal and Pelvic Floor Dysfunction, 20(7), pp.837–842.
Hill, J.B. et al., 1990. Acute pyelonephritis in pregnancy. American Family Physician, 42(4), p.1069.
Hooton, T.M. et al., 1996. A prospective study of risk factors for symptomatic urinary tract infection in young women. The New England journal of medicine, 335(7), pp.468–74. Available at: http://www.ncbi.nlm.nih.gov/pubmed/8672152.
Hopkins, W.J., et al., 2007. Vaginal mucosal vaccine for recurrent urinary tract infections in women: results of a phase 2 clinical trial. J Urol 177(4):1349-53.
Jepson, R., Williams, G. & Craig, J., 2012. Cranberries for preventing urinary tract infections. Cochrane Database Syst Rev, 10, p.CD001321.
Kahlmeter, G., 2003. An international survey of the antimicrobial susceptibility of pathogens from uncomplicated urinary tract infections: the ECO.SENS Project. J Antimicrob Chemother., 51(1), pp.69–76.
Kontiokari, T. et al., 2001. Randomised trial of cranberry-lingonberry juice and Lactobacillus GG drink for the prevention of urinary tract infections in women. British Medical Journal, 322(7302), p.1571.
Maki, K.C. et al., 2016. Consumption of a cranberry juice beverage lowered the number of clinical urinary tract infection episodes in women with a recent history of urinary tract infection. American Journal of Clinical Nutrition, 103(6), pp.1434–1442.
Melekos, M.D. et al., 1997. Post-intercourse versus daily ciprofloxacin prophylaxis for recurrent urinary tract infections in premenopausal women. Journal of Urology, 157(3), pp.935–939.
Minardi, D. et al., 2011. Urinary tract infections in women: etiology and treatment options. International journal of general medicine, 4(April 2016), pp.333–43. Available at: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=3108201&tool=pmcentrez&rendertype=abstract.
Nicolle, L. et al., 1989. Prospective, randomized, placebo-controlled trial of norfloxacin for the prophylaxis of recurrent urinary tract infection in women. Antimicrob Agents Chemother, 33, pp.1032–35.
Nicolle, L., Harding, G. & Thomson, M., 1988. Efficacy of five years of continuous, low-dose trimethoprim-sulfamethoxazole prophylaxis for urinary tract infection. J Infect Dis., 157(6), pp.1239–42.
Oplinger, M. & Andrews, C.O., 2013. Nitrofurantoin Contraindication in Patients with a Creatinine Clearance Below 60 mL/min: Looking for the Evidence. Annals of Pharmacotherapy, 47(1), pp.106–11.
Pagano, M.J. et al., 2017. Diagnostic Yield of Cystoscopy in the Evaluation of Recurrent Urinary Tract Infection in Women. Neurourology and urodynamics, 36(3), pp.692–96.
Price, J.R. et al., 2016. Nitrofurantoin versus other prophylactic agents in reducing recurrent urinary tract infections in adult women. A Systematic Review and Meta-analysis. American journal of obstetrics and gynecology, 215(5), pp.548–560. Available at: http://www.ncbi.nlm.nih.gov/pubmed/27457111.
Raz, R. et al., 2000. Recurrent Urinary Tract Infections in Postmenopausal Women. , 98195(356523), pp.152–156.
Reid, G., Bruce, A. & Taylor, M., 1992. Influence of 3-day antimicrobial therapy and Lactobacillus vaginal suppositories on recurrence of urinary tract infections. Clin Ther, 14, pp.11–16.
Reid, G., Bruce, A. & Taylor, M., 1995. Instillation of Lactobacillus and stimulation of indigenous organisms to prevent recurrence of urinary tract infections. Microecol Ther, 23, pp.32–45.
Scholes, D. et al., 2000. Risk factors for recurrent urinary tract infection in young women. The Journal of infectious diseases, 182(4), pp.1177–82. Available at: http://www.ncbi.nlm.nih.gov/pubmed/10979915.
Stamm, W., 2007. Estrogens and urinary tract infection. J Infect Dis, 195, p.623.
Stamm, W., Counts, G. & Wagner, K., 1980. Antimicrobial prophylaxis of recurrent urinary tract infections: a double-blind placebo-controlled trial. Ann Intern Med, 92, pp.770–75.
Stapleton, A. et al., 1990. Postcoital antimicrobial prophylaxis for recurrent urinary tract infection. A randomized, double-blind, placebo-controlled trial. Jama, 264(6), pp.703–706.
Stapleton, A.E. et al., 2012. Recurrent urinary tract infection and urinary Escherichia coli in women ingesting cranberry juice daily: A randomized controlled trial. Mayo Clinic Proceedings, 87(2), pp.143–150. Available at: http://dx.doi.org/10.1016/j.mayocp.2011.10.006.
Stothers, L., 2002. A randomized trial to evaluate effectiveness and cost effectiveness of naturopathic cranberry products as prophylaxis against urinary tract infection in women. Can J Urol, 9(3), pp.1558–62.
Suskind, A.M. et al., 2016. Incidence and Management of Uncomplicated Recurrent Urinary Tract Infections in a National Sample of Women in the United States. Urology, 90(2016), pp.50–55. Available at: http://dx.doi.org/10.1016/j.urology.2015.11.051.
Wang, C. & Fang, C., 2012. Cranberry-containing products for prevention of urinary tract infections in susceptible populations: a systematic review and meta-analysis of randomized controlled. Archives of …, 172(13), pp.988–996. Available at: http://archpsyc.jamanetwork.com/article.aspx?articleid=1213845.
Yamamoto, S. et al., 1997. Genetic evidence supporting the fecal-perineal-urethral hypothesis in cystitis caused by Escherichia coli. Journal of Urology, 157(3), pp.1127–1129.
1 Professor Assistente da Disciplina de Ginecologia e Obstetrícia – Universidade Estadual do Oeste do Paraná
2 Doutorando do Programa de Pós-Graduação em Ginecologia e Obstetrícia; Faculdade de Medicina de Ribeirão Preto – Universidade de São Paulo
3 Professor Doutor do Departamento de Tocoginecologia - Universidade Estadual de Campinas
Introdução
Infecções do trato urinário (ITUs) correspondem à presença de microorganismos patogênicos nas vias urinárias inferiores ou superiores. São frequentemente consideradas um dos subtipos mais comuns de infecção bacteriana em humanos (Foxman 2003). Tais infecções podem acometer o trato urinário baixo, manifestando-se como uretrites e cistites, ou alto, manifestando-se como pielonefrites. As ITUs são mais frequentes nas mulheres, em comparação aos homens, e se estima que cerca de metade das mulheres terão ao menos um episódio de ITU ao longo da vida (Griebling 2005). Um número bem mais restrito de mulheres desenvolve quadros cronicamente recorrentes de ITUs, dando origem à condição conhecida como ITU recorrente, ou ITU de repetição, que é definida pela International Continence Society / International Urogynecology Association como o diagnóstico de três episódios de infecção no curso de 12 meses, ou dois episódios em seis meses, com demonstração objetiva de resolução de cada um dos episódios após tratamento (Haylen et al. 2010). Uma coorte de base populacional norte-americana, com duração de 9 anos, estimou uma incidência de ITUs recorrentes não complicadas de 102 em 100.000 mulheres, ou cerca de 0,1%, com predomínio nas faixas etárias entre 18 a 34 anos, e entre 55 a 64 anos (Suskind et al. 2016). Apesar de tais episódios serem geralmente leves e auto-limitados, eles podem determinar um prejuízo significativo na qualidade de vida dessas mulheres, com irritabilidade, perda de produtividade no trabalho, perda de auto-estima e comprometimento da função sexual (Boeri et al. 2017).
Etiologia e Fisiopatologia
Múltiplos microorganismos podem ser responsáveis por ITUs, tais como Klebsiella spp., Pseudomonas spp., Enterobacter spp., Serratia spp., Klebsiella spp., Proteus spp. e Enterococcus spp (Boeri et al. 2017). Sabe-se porém, que a bactéria mais frequentemente associada a tais infecções é a Escherichia coli, responsável por 60 a 80% dos casos (Kahlmeter 2003). E.coli é um microorganismo normal da flora intestinal humana, sendo que a maior parte das cepas não possui capacidade de produzir doença. Algumas cepas, porém, são virulentas, responsáveis por infecções intestinais invasivas, ou por infecções extra-intestinais, como é o caso das E. coli uropatogênicas (UPEC) associadas aos quadros de ITU (Bien et al. 2012). Considerando a curta distância entre o ânus e o meato uretral externo feminino, mulheres que possuem cepas UPEC de E.coli em sua microbiota intestinal podem disseminar tais microorganismos ao períneo e introito vaginal, permitindo a ascensão dos mesmos ao trato urinário inferior. Quando tal disseminação acontece, essas bactérias aderem à mucosa do trato urinário através de estruturas denominadas fímbrias, que possuem papel importante como determinantes da virulência das cepas UPEC (Bower et al. 2005). O turnover celular acelerado da superfície da mucosa do trato urinário, com esfoliação celular, e o próprio fluxo urinário consistem em mecanismos de defesa contra a aderência de tais bactérias à superfície mucosa, impedindo que a ascensão das mesmas determine um quadro de infecção. Quando, porém, tais mecanismos não são capazes de remover as bactérias aderidas, pode haver invasão da superfície mucosa pelos microorganismos, com estabelecimento de um processo infeccioso invasivo. Apesar de classicamente ser considerada uma infecção extracelular, mais recentemente tem-se reconhecido a capacidade das UPECs de invadirem as células uroteliais e estabelecerem uma colonização intracelular crônica, que resiste aos mecanismos de defesa inatos e mesmo ao tratamento com antimicrobianos, e se associa com quadros recorrentes de ITU (Bower et al. 2005).
Fatores de Risco
Como mencionado previamente, mulheres já estão sob risco mais elevado para o desenvolvimento de ITUs, e isso se relaciona às características anatômicas do trato genito-urinário feminino. A proximidade entre ânus e uretra e o fato de a uretra feminina ser mais curta que a masculina contribui para um maior risco de uropatógenos ascenderem ao trato urinário inferior (Yamamoto et al. 1997).
Além disso, diversos outros fatores de risco estão relacionados ao desenvolvimento de ITUs, especialmente de quadros recorrentes.
- Vida sexual ativa: mulheres sexualmente ativas estão sob maior risco de desenvolverem ITU; além disso, características específicas da vida sexual da mulher também podem aumentar tal risco, tais como maior frequência das relações sexuais (≥ 3 vezes por semana resultou em uma chance cinco vezes maior de ITU; OR = 5,6; IC 95%3,1 – 10,1), uso de diafragma ou de espermicidas como método contraceptivo, novos parceiros sexuais, práticas inadequadas de higiene genital, como falta de higiene antes (OR = 2,1, IC95% 1,2 a 3,6) e após (OR = 2,8, IC95% 1,5 a 9,8) o coito (Badran et al. 2015).
- Gravidez: a gestação se associa a uma maior estase de urina no trato genital inferior e superior, seja por dificuldades de esvaziamento associadas à compressão pelo útero gravídico, seja pelo peristaltismo ureteral reduzido e leve dilatação ureteral observado durante a gestação. Essa tendência a estase perturba um dos mecanismos de proteção do trato urinário contra a aderência e invasão bacterianas – o fluxo de urina e esvaziamento miccional, que acaba levando a descamação de células superficiais e a eliminação de bactérias eventualmente aderidas. Tais modificações aumentam a prevalência de bacteriúria assintomática, pielonefrite e quadros recorrentes de ITU durante a gravidez (Hill et al. 1990).
- Menopausa: durante o menacme, a microbiota vaginal é rica em lactobacilos, capazes de manter o meio vaginal acidificado, o que dificulta a colonização por enterobactérias patogênicas que podem ascender através da uretra e causar ITUs. O hipoestrogenismo observado na menopausa provoca alterações na microbiota e atrofia da mucosa vaginal, com perda de lactobacilos e elevação do pH do meio, fatores que se relacionam com um maior risco de colonização vaginal por uropatógenos e infecções ascendentes (Minardi et al. 2011).
- Incontinência urinária e disfunções miccionais: a presença de um esvaziamento vesical lento ou incompleto, e de resíduos pós miccionais superiores a 30mL se associa a um maior risco de quadro recorrentes de ITU (Haylen et al. 2009; Raz et al. 2000). Além disso, mulheres que apresentam incontinência urinária têm seis vezes mais chances de desenvolverem ITU de repetição em comparação a mulheres sem incontinência (OR 6,65, IC95% 2,5 – 17,7) (Raz et al. 2000).
- Fatores obstrutivos – prolapso genital, litíase renal, válvula de uretra posterior, refluxo vesico-ureteral, uso de cateterização prolongada ou intermitente são situações que podem levar a estase urinária.
Por definição, quadros recorrentes de ITU necessitam de comprovação microbiológica através de urocultura (Haylen et al. 2010). Outras investigações, porém, não são recomendadas de forma rotineira para a maioria dessas mulheres, devido à baixa custo-efetividade e baixa utilidade diagnóstica. Apesar disso, sabe-se que a presença de anomalias estruturais, corpos estranhos no trato urinário, e urolitíase podem estar associados a quadros recorrentes de ITU, e tais condições podem ser potencialmente detectadas e tratadas. Sendo assim, investigação urológica utilizando exames de imagem (incluindo urografia excretora, tomografia computadorizada e ultrassonografia de rins e vias urinárias) e cistoscopia podem ser indicados de maneira individualizada, se houver suspeita de alguma dessas condições (Chew 1999). Em um estudo retrospectivo envolvendo 163 mulheres com ITU de repetição submetidas a investigação urológica complementar, apenas 5,5% apresentaram algum achado anormal (incluindo divertículo vesical, estenose uretral e presença de sutura na bexiga); tal amostra, porém, continha uma proporção significativa de mulheres já submetidas a cirurgias uroginecológicas e a transplante renal, e a proporção de achados positivos deve ser possivelmente inferior em mulheres que não possuem tais fatores de risco (Pagano et al. 2017). A urodinâmica não contribui na elucidação da causa da ITU de repetição.
Estratégias para Prevenção
Uma série de possíveis medidas e tratamentos pode ser instituída em mulheres que apresentam quadros recorrentes de ITU, incluindo medidas comportamentais e uma série de agentes.
Escolha de método contraceptivo
O uso de diafragma, capuz cervical e espermicidas (mesmo preservativos masculinos contendo espermicidas) eleva o risco de ITU recorrente. Mulheres com tais quadros e que utilizam tais métodos podem discutir métodos alternativos de contracepção (Hooton et al. 1996).
Hábitos de higiene e micção
Apesar de a evidência ser limitada, a realização de higiene perineal e micção precocemente após o coito, além da ingesta abundante de líquidos visando aumentar o débito urinário, pode contribuir para redução do risco (Scholes et al. 2000).
Antibióticos
O uso de antimicrobianos em regimes de profilaxia, ou o tratamento auto-administrado pela mulher ao sentir os primeiros sintomas de uma ITU, são possíveis modalidades de manejo utilizando antibióticos. É importante dizer que não existem trabalhos com mais de seis meses de antibioticoprofilaxia mostrando qual deverá ser a sequencia de tratamento mais adequada após o primeiro tratamento.
O uso de regimes contínuos, diários, de profilaxia já foi extensamente estudado por inúmeros estudos controlados, utilizando diferentes antibióticos (nitrofurantoína, sulfametoxazol-trimpetoprim, norfloxacino), comparados entre si e com placebo (Nicolle et al. 1989; Brumfitt & Smith 1985; Stamm et al. 1980), e demonstram excelente eficácia em reduzir a incidência de recorrências quando comparados ao placebo. Uma meta-analise da fundação Cochrane envolvendo 10 ensaios controlados e 430 mulheres (Albert et al. 2004), comparando múltiplos antibióticos versus placebo, demonstrou um redução de quase 80% [RR = 0,21 (IC95% 0,13 a 0,34)] para um episódio de recorrência microbiológica no grupo antibiótico. A recorrência clínica também foi significativamente reduzida com antibiótico. Por outro lado, os grupos que utilizaram antimicrobianos apresentaram maior incidência de efeitos adversos, incluindo candidíase genital e sintomas gastrointestinais. Na comparação entre os diversos antibióticos, individualmente, não se obteve evidência de superioridade de nenhum dos agentes. Tem sido dada preferência do uso à nitrofurantoína para essa indicação, devido ao perfil desse agente de atingir concentrações clinicamente significativas somente no trato urinário, tendo, teoricamente, menor potencial de interferir com a microbiota de outros órgãos, como o intestino e a vagina (Price et al. 2016). O uso de nitrofurantoína por períodos muito prolongados, porém, pode se associar a fibrose pulmonar e a hepatotoxicidade, especialmente em pacientes com insuficiência renal e clearance de creatinina inferior 30mL/min (Oplinger & Andrews 2013). Além dos efeitos adversos, outro problema associado a profilaxia contínua com antibióticos é o potencial de desenvolvimento resistência microbiana ao agente utilizado, o que já foi observado em estudos com sulfametoxazol-trimetoprim (SMX-TMP) e com ciprofloxacino (Melekos et al. 1997; Nicolle et al. 1988). O tempo de uso de regimes contínuos de profilaxia é motivo de controvérsia; alguns autores sugerem o uso por seis meses, seguido de um período de observação sem antibióticos, mas períodos mais prolongados, de até cinco anos, já foram estudados, e podem ser utilizados em mulheres que retomam os quadros de infecções recorrentes após suspensão do regime de profilaxia (Nicolle et al. 1988).
Para mulheres em que se observa uma relação entre os quadros recorrentes de ITU e a atividade sexual, uma alternativa ao uso contínuo de antibioticoprofilaxia é a administração desses agentes após o coito, em um regime de profilaxia pós coital. Um estudo comparando a profilaxia pós-coital com ciprofloxacino 125mg versus uso contínuo da mesma dose diária observou redução comparável na incidência de ITUs sintomáticas (De 3,6 e 3,7 ITUs por paciente-ano para 0,46 e 0,42 ITUs por paciente-ano nos grupos de profilaxia pós-coital e contínua, respectivamente) (Melekos et al. 1997). Na comparação com placebo, SMX-TMP em regime pós coital foi significativamente melhor em reduzir a incidência dos quadros de infecção em outro estudo controlado (com 3,6 e 0,3 ITUs por paciente-ano nos grupos placebo e profilaxia pós-coital, respectivamente) (Stapleton et al. 1990). Resumindo, não há diferença de eficácia entre a profilaxia contínua e a de pós-coito.
Outra estratégia para minimizar a exposição aos antimicrobianos e o impacto sobre a resistência bacteriana é o auto-tratamento, mediante o reconhecimento, pela mulher, dos sintomas sugestivos de um novo quadro de ITU. Já se demonstrou uma acurácia de 85% a 95% para o auto-diagnóstico de ITU pela mulher, com base em seus sintomas (Gupta & Hooton 2001). A orientação médica é especialmente importante nesta estratégia, para que a mulher seja aderente às instruções e procure assistência em casos de persistência.
Cranberry
Existe evidência experimental de longa data demonstrando, in vitro, que extratos de cranberry reduzem a capacidade das E. coli uropatogênicas aderirem ao epitélio urotelial. O efeito clínico de tal propriedade, porém, é motivo de controvérsia. Alguns ensaios clínicos randomizados que compararam o uso de produtos derivados de cranberry (suco ou capsulas) com placebo demonstraram redução na incidência de novos episódios de ITU e de bacteriúria / piúria (Maki et al. 2016; Stothers 2002; Kontiokari et al. 2001). Por outro lado, outros ensaios randomizados com comparações semelhantes não observaram diferença entre os grupos, sendo o número de recorrência observadas com o cranberry equivalente às do placebo (Barbosa-Cesnik et al. 2011; Stapleton et al. 2012). Mesmo meta-análises de ensaios randomizados não apresentam resultados consistentes. Uma revisão sistematizada com meta-análise demonstrou benefício em mulheres com ITUs recorrentes (RR = 0,53, IC95% 0,33-0,83), mas com elevada heterogeneidade clínica entre os ensaios (diferentes doses, diferentes produtos de cranberry, diferentes definições de ITU) (Wang & Fang 2012). Já uma outra revisão sistematizada com meta-análise, da fundação Cochrane, incluindo um maior número de estudo e agregando mais participantes (24 estudos e 4473 mulheres) não demonstrou diferença significativa entre cranberry e nenhum tratamento ou placebo (RR = 0,86, IC95% 0,71 a 1,04) (Jepson et al. 2012).
Não há evidência definitiva para se recomendar o uso de cranberry como tratamento eficaz em substituição aos antibióticos para mulheres com ITU de repetição, apesar de haver um mecanismo de ação plausível, e de vários ensaios clínicos sugerirem benefício. Por outro lado, em mulheres que desejem tentar tratamentos que não envolvam antimicrobianos, provavelmente os riscos e potenciais efeitos adversos são escassos e não haveria um malefício no seu uso.

Terapia hormonal tópica
Em mulheres menopausadas com quadros de ITU recorrente, o uso de terapia tópica com estrogênio é considerado eficaz em reduzir o risco de recorrências. O hormônio tópico reestabelece a flora vaginal normal, com redução do pH vaginal e menor potencial de colonização por enterobactérias (Stamm 2007).
Lactobacilos
O uso de probióticos, especialmente contendo lactobacilos, foi estudado devido ao potencial desses agentes de manter um pH vaginal reduzido, de reduzir a adesividade dos uropatógenos, e de produzir peróxido de hidrogênio, que pode eliminar enterobactérias do meio vaginal. Dentre quatro ensaios clínicos randomizados estudando o uso de lactobacilos administrados através de cápsulas vaginais, não se observou diferença significativa em comparação a placebo e a extrato lácteo em três desses estudos (Baerheim et al. 1994; Reid et al. 1992; Kontiokari et al. 2001); no quarto estudo, que comparou lactobacilos com fator de crescimento de lactobacilos (que teria a função de estimular a replicação da microbiota vaginal normal), também não se observou diferença entre as duas intervenções, mas os autores afirmam que houve uma incidência 73% menor em ambos os grupos em comparação aos 12 meses antes das intervenções (de 6 episódios por paciente-ano para 1,6 e 1,3 para os grupos lactobacilo e fator de crescimento, respectivamente) (Reid et al. 1995)
A evidência é escassa e insuficiente para permitir uma recomendação quanto à eficácia do uso de lactobacilos vaginais para a prevenção de ITUs. Os riscos associados a tal intervenção, no entanto, são muito escassos, sendo apenas relatados episódios de bacteremia por probióticos em pacientes gravemente imunossuprimidos (Barrons & Tassone 2008).
Imunoestimulantes
O uso de um extrato proveniente de 18 sorotipos de E.coli inativados por calor, denominado OM-89, é capaz de estimular tanto a imunidade inata quanto a adquirida, resultando em maior recrutamento de neutrófilos e células dendríticas, e na produção de imunoglobulinas G e A, específicas para os antígenos presentes no extrato de E.coli. Tal composto foi estudado por múltiplos ensaios clínicos, e uma meta-análise incluindo 4 estudos e 891 mulheres demonstrou uma redução significativa no número de recorrências (RR = 0,61, IC95% 0,48 a 0,78) em comparação a placebo. Além disso, não foram observados efeitos adversos significativos em comparação ao placebo (Beerepoot et al. 2013).
Um lisado via vaginal (formato de supositório) de seis cepas de E. coli, uma cepa de Proteus, Morganella, K. pneumoniae e E. faecalis está em teste. Aparentemente, mostrou um maior tempo de reinfecção do que no placebo e menor incidência da ITU nas primeiras 4 semanas, porém sem diferença com 20 semanas. Um segundo estudo com uma dose de reforço após primeira aplicação diminuiu infecção (Hopkins et al. 2007)
Conclusões
Infecções do trato urinário recorrentes podem ter um impacto significativo sobre a qualidade de vida das mulheres afetadas. Inúmeros fatores de risco são conhecidos, e alguns deles são modificáveis e/ou tratáveis, como comportamento sexual, uso de diafragmas e atrofia urogenital. Para aquelas mulheres que mantêm quadros recorrentes mesmo com medidas comportamentais e com tratamento da atrofia associada à menopausa, uma série de outras intervenções pode ser tentada, sendo o uso de antibióticos de forma profilática a mais extensamente estudada. Alternativas ao uso de anti-microbianos, tais como o consumo de cranberry e o uso de probióticos contendo lactobacilos podem ser tentadas, mas a evidência acerca da eficácia das mesmas é inconsistente. Por outro lado, o uso do OM-89 como imunoestimulante é mais eficaz que o placebo e comprovadamente reduz recorrências, sendo uma boa estratégia em pacientes com ITUs recorrentes por E.coli que não desejam utilizar antibióticos, ou quando os mesmos não forem eficazes.
Referências
Albert, X., Huertas, I. & Pereiró, I., 2004. Antibiotics for preventing recurrent urinary tract infection in non-pregnant women. Cochrane Database Syst Rev, p.CD001209.
Badran, Y.A. et al., 2015. Impact of genital hygiene and sexual activity on urinary tract infection during pregnancy. Urology Annals, 7(4), pp.478–481. Available at: https://www.scopus.com/inward/record.uri?eid=2-s2.0-84945955096&partnerID=40&md5=7d8315dd8acf6cca9d01fe9c05e779ad.
Baerheim, A., Larsen, E. & Digranes, A., 1994. Vaginal application of Lactobacilli in the prophylaxis of recurrent lower urinary tract infection in women. Scand J Prim Health Care., 12, pp.239–43.
Barbosa-Cesnik, C. et al., 2011. Cranberry Juice Fails to Prevent Recurrent Urinary Tract Infection: Results From a Randomized Placebo-Controlled Trial. Clinical Infectious Diseases, 52(1), pp.23–30. Available at: http://cid.oxfordjournals.org//cgi/doi/10.1093/cid/ciq073 [Accessed December 9, 2010].
Barrons, R. & Tassone, D., 2008. Use of Lactobacillus probiotics for bacterial genitourinary infections in women: A review. Clinical Therapeutics, 30(3), pp.453–468.
Beerepoot, M.A.J. et al., 2013. Nonantibiotic prophylaxis for recurrent urinary tract infections: A systematic review and meta-analysis of randomized controlled trials. Journal of Urology, 190(6), pp.1981–1989. Available at: http://dx.doi.org/10.1016/j.juro.2013.04.142.
Bien, J., Sokolova, O. & Bozko, P., 2012. Role of uropathogenic escherichia coli virulence factors in development of urinary tract infection and kidney damage. International Journal of Nephrology, 2012.
Boeri, L. et al., 2017. Six Out of Ten Women with Recurrent Urinary Tract Infections Complain of Distressful Sexual Dysfunction – A Case-Control Study. Scientific Reports, 7(February), p.44380. Available at: http://www.nature.com/articles/srep44380.
Bower, J.M., Eto, D.S. & Mulvey, M.A., 2005. Covert operations of uropathogenic Escherichia coli within the Urinary Tract. Traffic, 6(1), pp.18–31.
Brumfitt, W. & Smith, G., 1985. A clinical comparison between Macrodantin and trimethoprim for prophylaxis in women with recurrent urinary infections. J Antimicrob Chemother, 16(1), pp.111–20.
Chew, L.F.S., 1999. Recurrent cystitis in nonpregnant women. West J Med, 170(5), pp.274–77.
Foxman, B., 2003. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs. Dis. Mon., 49(2), pp.53–70.
Griebling, T., 2005. Urologic diseases in America project: trends in resource use for urinary tract infections in women. The Journal of Urology, 173(4), pp.1281–7.
Gupta, K. & Hooton, T., 2001. Patient-initiated treatment of uncomplicated recurrent urinary tract infections in young women. Annals of internal medicine, pp.9–16. Available at: http://annals.org/article.aspx?articleid=714601.
Haylen, B.T. et al., 2010. An International Urogynecological Association (IUGA)/International Continence Society (ICS) joint report on the terminology for female pelvic floor dysfunction. International urogynecology journal, 21(1), pp.5–26. Available at: http://www.ncbi.nlm.nih.gov/pubmed/19937315 [Accessed May 21, 2013].
Haylen, B.T. et al., 2009. Recurrent urinary tract infections in women with symptoms of pelvic floor dysfunction. International Urogynecology Journal and Pelvic Floor Dysfunction, 20(7), pp.837–842.
Hill, J.B. et al., 1990. Acute pyelonephritis in pregnancy. American Family Physician, 42(4), p.1069.
Hooton, T.M. et al., 1996. A prospective study of risk factors for symptomatic urinary tract infection in young women. The New England journal of medicine, 335(7), pp.468–74. Available at: http://www.ncbi.nlm.nih.gov/pubmed/8672152.
Hopkins, W.J., et al., 2007. Vaginal mucosal vaccine for recurrent urinary tract infections in women: results of a phase 2 clinical trial. J Urol 177(4):1349-53.
Jepson, R., Williams, G. & Craig, J., 2012. Cranberries for preventing urinary tract infections. Cochrane Database Syst Rev, 10, p.CD001321.
Kahlmeter, G., 2003. An international survey of the antimicrobial susceptibility of pathogens from uncomplicated urinary tract infections: the ECO.SENS Project. J Antimicrob Chemother., 51(1), pp.69–76.
Kontiokari, T. et al., 2001. Randomised trial of cranberry-lingonberry juice and Lactobacillus GG drink for the prevention of urinary tract infections in women. British Medical Journal, 322(7302), p.1571.
Maki, K.C. et al., 2016. Consumption of a cranberry juice beverage lowered the number of clinical urinary tract infection episodes in women with a recent history of urinary tract infection. American Journal of Clinical Nutrition, 103(6), pp.1434–1442.
Melekos, M.D. et al., 1997. Post-intercourse versus daily ciprofloxacin prophylaxis for recurrent urinary tract infections in premenopausal women. Journal of Urology, 157(3), pp.935–939.
Minardi, D. et al., 2011. Urinary tract infections in women: etiology and treatment options. International journal of general medicine, 4(April 2016), pp.333–43. Available at: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=3108201&tool=pmcentrez&rendertype=abstract.
Nicolle, L. et al., 1989. Prospective, randomized, placebo-controlled trial of norfloxacin for the prophylaxis of recurrent urinary tract infection in women. Antimicrob Agents Chemother, 33, pp.1032–35.
Nicolle, L., Harding, G. & Thomson, M., 1988. Efficacy of five years of continuous, low-dose trimethoprim-sulfamethoxazole prophylaxis for urinary tract infection. J Infect Dis., 157(6), pp.1239–42.
Oplinger, M. & Andrews, C.O., 2013. Nitrofurantoin Contraindication in Patients with a Creatinine Clearance Below 60 mL/min: Looking for the Evidence. Annals of Pharmacotherapy, 47(1), pp.106–11.
Pagano, M.J. et al., 2017. Diagnostic Yield of Cystoscopy in the Evaluation of Recurrent Urinary Tract Infection in Women. Neurourology and urodynamics, 36(3), pp.692–96.
Price, J.R. et al., 2016. Nitrofurantoin versus other prophylactic agents in reducing recurrent urinary tract infections in adult women. A Systematic Review and Meta-analysis. American journal of obstetrics and gynecology, 215(5), pp.548–560. Available at: http://www.ncbi.nlm.nih.gov/pubmed/27457111.
Raz, R. et al., 2000. Recurrent Urinary Tract Infections in Postmenopausal Women. , 98195(356523), pp.152–156.
Reid, G., Bruce, A. & Taylor, M., 1992. Influence of 3-day antimicrobial therapy and Lactobacillus vaginal suppositories on recurrence of urinary tract infections. Clin Ther, 14, pp.11–16.
Reid, G., Bruce, A. & Taylor, M., 1995. Instillation of Lactobacillus and stimulation of indigenous organisms to prevent recurrence of urinary tract infections. Microecol Ther, 23, pp.32–45.
Scholes, D. et al., 2000. Risk factors for recurrent urinary tract infection in young women. The Journal of infectious diseases, 182(4), pp.1177–82. Available at: http://www.ncbi.nlm.nih.gov/pubmed/10979915.
Stamm, W., 2007. Estrogens and urinary tract infection. J Infect Dis, 195, p.623.
Stamm, W., Counts, G. & Wagner, K., 1980. Antimicrobial prophylaxis of recurrent urinary tract infections: a double-blind placebo-controlled trial. Ann Intern Med, 92, pp.770–75.
Stapleton, A. et al., 1990. Postcoital antimicrobial prophylaxis for recurrent urinary tract infection. A randomized, double-blind, placebo-controlled trial. Jama, 264(6), pp.703–706.
Stapleton, A.E. et al., 2012. Recurrent urinary tract infection and urinary Escherichia coli in women ingesting cranberry juice daily: A randomized controlled trial. Mayo Clinic Proceedings, 87(2), pp.143–150. Available at: http://dx.doi.org/10.1016/j.mayocp.2011.10.006.
Stothers, L., 2002. A randomized trial to evaluate effectiveness and cost effectiveness of naturopathic cranberry products as prophylaxis against urinary tract infection in women. Can J Urol, 9(3), pp.1558–62.
Suskind, A.M. et al., 2016. Incidence and Management of Uncomplicated Recurrent Urinary Tract Infections in a National Sample of Women in the United States. Urology, 90(2016), pp.50–55. Available at: http://dx.doi.org/10.1016/j.urology.2015.11.051.
Wang, C. & Fang, C., 2012. Cranberry-containing products for prevention of urinary tract infections in susceptible populations: a systematic review and meta-analysis of randomized controlled. Archives of …, 172(13), pp.988–996. Available at: http://archpsyc.jamanetwork.com/article.aspx?articleid=1213845.
Yamamoto, S. et al., 1997. Genetic evidence supporting the fecal-perineal-urethral hypothesis in cystitis caused by Escherichia coli. Journal of Urology, 157(3), pp.1127–1129.






